La osteocondrosis es un afección degenerativa y no infecciosa en articulaciones que presenta un componente hereditario. La patogenia inicia con condronecrosis isquémica que progresa a una osificación anormal y posibles fracturas del cartílago articular. Se podría considerar que existe oportunidad de mejora en la causa inicial (80% de prevalencia entre 8 y 12 semanas de edad) o en la progresión (con 60-70% de recuperación a las 25 semanas de edad). Sin embargo, la etiología no está clara (Olstad y col., 2015) y podría incluir traumatismos, o fragilidad del colágeno (Laverty y Girard, 2013; Finnøy y col., 2017). Además, para reducir la prevalencia de OC debería aplicarse selección genética, aunque ello podría ser inicialmente difícil puesto que el potencial de crecimiento magro se asocia genéticamente con la OC (Aasmundstad y col., 2013). Por contra, otros factores que podrían afectar a la progresión de la enfermedad son poco conocidos.
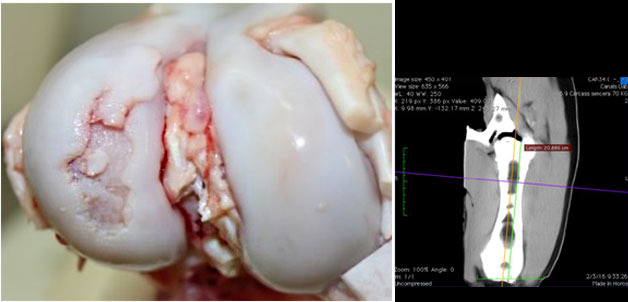

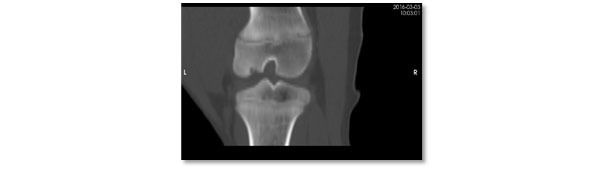
La utilización dietética de minerales, micro-minerales o algunos componentes funcionales (e.j. vitaminas) puede modificar la composición y estructura ósea (Riet y col., 2013). No obstante, su importancia en procesos patológicos es controvertida. Para el desarrollo óseo, el calcio (Ca) y el fósforo (P) son muy importantes. En la dieta, una relación mínima de Ca:P digestible es necesaria (1:1) y varía según el nivel de P; ej. 1.25:1 si P está a las recomendaciones (50 a 80 kg peso) NRC (2012). Además, las recomendaciones de Ca para maximizar la mineralización son mayores que para el crecimiento (<1.35:1; Lagos y col., 2018). Bajo deficiencia de P, la tasa de crecimiento y la mineralización ósea se reducen, no obstante, sin efectos en la OC.
El azufre es un mineral necesario para la resistencia del cartílago participando en la unión proteoglicanos-ácido hialurónico (Myllyharju, 2014), además, se le asocian efectos terapéuticos en lesiones articulares (Ouattara y col., 2016). En nulíparas, la suplementación de metionina (1,1:1 metionina:lisina) como fuente de azufre altamente disponible se asoció a una reducción de OC (Frantz y col., 2008). Asimismo, y para el magnesio, Counotte y col. (2014) reportó mejoras en OC en potros suplementados con 4 g/d entre los 5-12 meses de edad.
Los minerales traza (MT) también son elementos esenciales, no obstantemente, existen diferencias notables entre las necesidades de crecimiento y las recomendaciones prácticas. De hecho, algunos sugieren mayores necesidades para el desarrollo óseo y pezuñas que para el crecimiento (ej. pavos, Ferket y col., 2009; y cerdos, Barneveld y Vandepeer, 2008). Sin embargo, se necesita mayor evidencia práctica. El zinc (Zn) interactúa con varios componentes de la matriz extracelular ósea (ej. osteoblastos, metaloproteinasas y factores de crecimiento). Así, el aumento de Zn en la dieta incrementa el contenido en cenizas y la resistencia ósea linealmente (Veum y col., 2009). De manera similar, el silicio maximiza la formación de colágeno. Suplementando cerdos (1.000 mg silicio/kg pienso) se han observado reducciones de OC (Frantz y col., 2008). De lo contrario, aunque el manganeso participa en la síntesis de proteoglicanos no afecta la OC. El cobre (Cu), es aparentemente más importante y cataliza la Cu-lisil oxidasa proporcionando resistencia al colágeno. La suplementación combinada de Cu (250 mg/kg) y Mn (100 mg/kg) mejoró las propiedades biomecánicas del cartílago y redujo la OC (Frantz y col., 2008). Contrariamente, Tóth y col. (2016) utilizaron fuentes de MT inorgánicas + orgánicas (150 + 50 g/kg Zn, 50 + 20 mg/kg Cu, y 16.5 + 10mg/kg Mn) sin observar efectos aparentes sobre la OC a edades tempranas (12 semanas; 100% prevalencia de OC) o tardías (24 semanas, 1,5% de prevalencia de OC). Así, todos los niveles basales en sus tratamientos parecían suficientes para reducir la progresión de la OC. Por otro lado, una suplementación similar de MT redujo la incidencia de cojeras y mejoró la calidad del hueso (Fabà y col., 2018; 2019). Dichos resultados conflictivos sugieren otras hipótesis más prácticas: ¿puede el potencial de los MT interactuar con el riesgo inherente o mecánico a sufrir OC? o de lo contrario, ¿hay interacciones entre los minerales u otros componentes de la dieta (es decir, antimicrobianos, ZnO, fitato, etc.) que puedan causar deficiencias temporales y que afecten a la OC? De hecho, el exceso de Zn puede desplazar la metalotioneína de Cu y la enzima lisil oxidasa dependiente de Cu), resultando en la producción anormal de cartílago y hueso. Cuestión que es crítica en la fase de pre-starter coincidiendo con la aparición de OC. No obstante, tales interacciones requieren niveles terapéuticos o mayores de ZnO (Hill y col., 1983).
Otras deficiencias, como vitaminas (ej. B folacina) pueden presentar consecuencias negativas en el desarrollo óseo. La deficiencia más importante es para la vitamina D que reduce la disponibilidad de Ca y P, afecta al metabolismo óseo y además otras funciones fisiológicas (Clarke, 2008). No obstante, los suplementos de vitamina A, B, C, D y E no influyen la OC (Nakano y col., 1987, Ytrehus y col., 2007).
Altos niveles de azúcares aumentan los picos de insulina y factor de crecimiento insulínico. Estos efectos pueden comprometer la actividad condrocítica, aunque son de amplio espectro y no se ha demostrado que aumenten la OC en cerdos. Otras suplementaciones como el sulfato de glucosamina o los glicosaminoglicanos (ej. condritin sulfato), o los ácidos grasos n-3 se han propuesto para mejorar la formación de proteoglicanos y cartílago, aunque no se han observado efectos sobre la OC en nulíparas (Neil y col., 2005; Frantz y col., 2008).
Resulta claro que las deficiencias nutricionales reducen la calidad de hueso y pueden influenciar la OC. Pero el conflicto entre resultados cuestiona el potencial de los suplementos nutricionales sobre la OC. Más investigación es necesaria para entender su patogenia y progresión, especialmente incluyendo interacciones a nivel práctico con la velocidad de crecimiento, la genética, y el manejo.



